阿尔兹海默病(Alzheimer's disease,AD)是一种常见的神经退行性疾病,临床表现为记忆丧失和认知障碍,严重影响人类的正常生活。研究发现Tau蛋白错误折叠组装形成神经原纤维缠结是AD的关键致病因素之一,因此对这些蛋白纤维结构进行精准检测以及探索折叠背后的分子机制可以为后续AD诊断和治疗提供新思路。
在分子结构上,Tau蛋白C末端在自组装过程中首先折叠形成纤维的核心骨架,是Tau蛋白自组装发生的关键。同时,Tau蛋白自组装可能受到多种因素的影响,如分子手性和辅助因子。手性作为生物系统中至关重要的结构特征之一,在蛋白质生物合成中扮演着关键角色。然而,对于Tau蛋白的手性转换是否会影响其自组装行为尚不明确。肝素作为一种辅助因子,可通过静电效应调节蛋白结构及作用,从而影响Tau蛋白的自组装过程。但是,肝素如何调控手性Tau蛋白的自组装尚不清楚。
近日,重庆研究院研究人员将纳米孔测量技术和原子力显微成像结合,构建了一种全新的单分子生物物理检测平台,在手性Tau蛋白及其自组装结构精准检测研究中取得进展,相关成果发表在《Materials Today Physics》。研究人员从单分子和拓扑学方向入手,探究了手性转换和肝素对Tau蛋白自组装行为的调控作用。通过清晰地区分不同手性Tau蛋白单体和Tau蛋白自组装纤维结构,发现D-Tau蛋白的自组装倾向大于L-Tau蛋白;肝素会增强Tau蛋白的自组装倾向,辅助不同手性Tau蛋白形成螺旋方向相反、螺距不同的自组装纤维。该研究在分子水平上对手性Tau蛋白单体以及肝素辅助形成的蛋白自组装纤维进行了精确测量与区分,获得了传统方法难以获取的重要的蛋白自组装信息,为研究蛋白结构及蛋白自组装机制提供了新的思路和方法。
重庆研究院博士研究生陈伟、硕士研究生陈云昊为论文共同第一作者,王亮和王化斌为论文共同通讯作者。该工作得到了科技部国家重点研发计划、重庆英才、重庆市自然科学基金以及中科院“青促会”等项目的资助。
论文链接https://doi.org/10.1016/j.mtphys.2024.101370
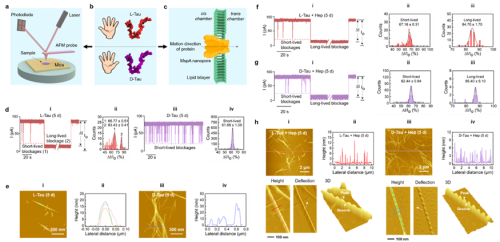
图一:Nanopore-AFM单分子生物物理检测平台对Tau蛋白自组装的精确观测。
